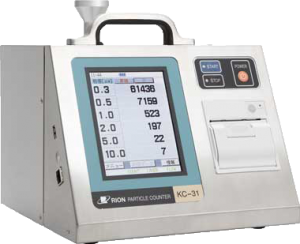
KC-31
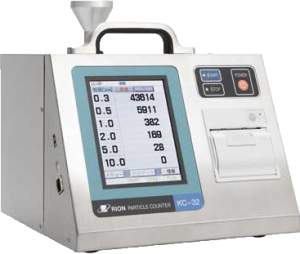
KC-32
気中パーティクルカウンタのKC-31/KC-32 は、ISO 21501-4(JIS B 9921)に適合し、医薬品製造環境における空気清浄度管理(ISO 14644-1、PIC/S GMP Annex1、EU-GMP Annex1 の清浄度クラスを評価)に適しています。また 大流量のため測定時間が短く、電子デバイスの製造現場でも役立ちます。一方、軽量でバッテリ駆動が可能なため測定場所を選びません。約5000 回の測定結果を内蔵メモリに保存し、USB メモリへコピーも可能です。また、筐体にステンレスを採用し、耐薬品性を向上しました。
◎ KC-31、KC-32のその他の特徴
・粒径区分が0.3、0.5、1.0、2.0、5.0、10.0μmです。
・環境に配慮し、リチウムイオン充電池を採用しています。本体に2個搭載して、長時間駆動も可能です(標準1個付属)。
・21 CFR Part 11に対応しています。
パスワードにより、権限レベル(管理者/使用者/ゲスト)で操作内容を区別します。
付属ソフトウェア(Log Viewer)を使用して操作履歴を確認できます。
・表示言語は、日本語、英語を選択可能です。
◎ KC-31、KC-32の仕様一覧
| 品名 | 気中パーティクルカウンタ | |
|---|---|---|
| 型式 | KC-31 | KC-32 |
| 光源 | 半導体レーザ (波長 780nm、定格出力100mW) | |
| 定格流量 | 28.3L/min | 50L/min |
| 粒径区分(6段階) | 0.3μm以上、0.5μm以上、1.0μm以上、 2.0μm以上、5.0μm以上、10.0μm以上 |
|
| 最大粒子個数濃度 | 28,000,000個/m3 (計数損失10%以内) |
16,000,000個/m3 (計数損失10%以内) |
| サンプリング チューブ径 |
外径Φ16mm、内径Φ12mm | |
| 電源 | リチウムイオン電池 または ACアダプタ (AC100 - 240V, 50/60Hz) |
|
| 大きさ | 約H203 x W260 x D266mm | |
| 重量 | 約5.5kg(バッテリ1個搭載時) | |
◎ 気中微粒子の管理
空気中に飛散した細菌は、浮遊する微粒子に付着して運ばれることが多いため、医薬品や食品製造の分野において、空気中の微粒子濃度が規制されています。
バイオテクノロジー、医療、製薬、食品工業でも異物混入、感染を防ぐ目的からクリーンルームを使用し、管理しています。クリーンルームの管理は粒子数による上限濃度だけでなく微生物の管理も必要になってきます。クリーンルームの清浄度クラスは、ISO14644-1により定められ、清浄度クラスは、1m³中に浮遊する粒径0.1μm以上の粒子数を10のべき数で表します。
JP、EU-GMP、FDAなどで浮遊菌の濃度が規定されており、粒子の上限濃度も規定されています。
無菌医薬品製造区域の空気清浄度
JP(日本薬局方)
| 空気の清浄度レベル | 最大許容粒子数 個/m3 | 空気微生物 | |||
|---|---|---|---|---|---|
| グレード | 非作業時 0.5μm | 非作業時 5μm | 作業時 0.5μm | 作業時 5μm | cfu/m3 |
| A | 3,520 | 20 | 3,520 | 20 | <1 |
| B | 3,520 | 29 | 352,000 | 2,900 | 10 |
| C | 352,000 | 2,900 | 3,520,000 | 29,000 | 100 |
| D | 3,520,000 | 29,000 | 200 | ||
EU-GMP(欧州薬局方)
| グレード | 最大許容粒子数 個/m3 | 空中微生物 cfu/m3 | |||
|---|---|---|---|---|---|
| 非作業時 0.5μm | 非作業時 5μm | 作業時 0.5μm | 作業時 5μm | 作業時 | |
| A | 3,520 | 20 | 3,520 | 20 | <1 |
| B | 3,520 | 29 | 352,000 | 2,900 | 10 |
| C | 352,000 | 2,900 | 3,520,000 | 29,000 | 100 |
| D | 3,520,000 | 29,000 | 200 | ||
FDA(米国食品医薬品局)
| 清浄域のクラス | 最大許容粒子数 個/m3 | 空中微生物 |
|---|---|---|
| 0.5μm | cfu/m3 | |
| 100 | 3,520 | <1 |
| 1,000 | 35,200 | 7 |
| 10,000 | 352,000 | 10 |
| 100,000 | 3,520,000 | 100 |
<製造区域の分類>(参考:JP16局第一追補参考情報)
製造区域とは、培養、抽出、精製、容器などの洗浄・乾燥、原料秤量、薬剤の調整、滅菌、充填、閉塞、梱包表示などの作業を行う場所、および更衣を行う場所などをいう。
無菌医薬品の製造区域は、取り扱う容器、原料および中間製品が微生物及び微粒子に汚染されることを防止するように維持・管理された区域。
グレードA:
製品への汚染リスクを高いレベルで防ぐ必要のある作業を行う局所的な区域。無菌操作法で製造される医薬品の場合は、無菌の医薬品、容器、栓などが暴露される環境において、無菌性が保持できるように設計された区域をいう。この区域においては充填前の無菌作業(無菌接続、無菌原料の添加など)、無菌充填、容器閉塞などを行う。
グレードB:
製品への汚染リスクを比較的高いレベルで防ぐ必要のある作業を行う多目的な区域。無菌操作法で製造される無菌医薬品の場合は、無菌を維持できるように収納された滅菌後の容器、原料および中間製品の搬入、無菌操作区域に直接介入する人、器具、装置などが所在する区域。一般的な無菌室では、グレードAの周辺環境となる。
グレードCおよびD:
製品への汚染リスクを比較的低いレベルで防ぐ区域。滅菌前の容器、原料および中間製品が、環境に暴露される製造作業を行う区域、無菌操作に使用する器具、装置などを洗浄する区域などをいう。



